 Perkiraan tentang gambaran atom tersebut dinamakan model atom. Itulah sebabnya mengapa model atom telah beberapa kali mengalami perubahan sesuai dengan perkembangan ilmu pengetahuan.
Perkiraan tentang gambaran atom tersebut dinamakan model atom. Itulah sebabnya mengapa model atom telah beberapa kali mengalami perubahan sesuai dengan perkembangan ilmu pengetahuan.Berikut teori-teori atom dari para ahli:
1. Teori atom Dalton (1803)
Teori atom pertama kali dikemukakan oleh John Dalton pada tahun 1803. Berdasarkan penelitiannya Dalton menyatakan hal-hal sebagai berikut:- Atom merupakan partikel terkecil yang tidak dapat dibagi lagi.
- Atom suatu unsur sama segala sifatnya, sedangkan atom dari unsur yang berbeda memiliki massa dan sifat yang berbeda pula.
- Senyawa terbentuk bila atom bergabung satu sama lain.
- Reaksi kimia hanya melibatkan penata ulangan atom-atom sehingga tidak ada atom yang berubah akibat reaksi kimia.
- Atom-atom dari unsur-unsur yang berlainan melakukan ikatan dengan perbandingan angka sederhana.
2. Teori atom J.J. Thomson (1897)
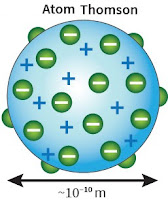
Model atom selanjutnya dikemukakan oleh J.J. Thomson pada tahun 1897. Dalam teorinya Thomson menyatakan hal-hal sebagai berikut:- Atom merupakan bola padat bermuatan positif dengan elektron terbesar di permukaannya sehingga teori ini juga banyak dikenal sebagai teori roti kismis
- Secara keseluruhan atom bersifat netral.
3. Teori atom Rutherford (1910)
Model atom selanjutnya dikemukakan oleh Ernest Rutherford pada tahun 1920. Pada teorinya, pernyataan yang dikemukakan yaitu:- Atom tersusun dari inti atom yang bermuatan positif (sebagai pusat massa) dan elektron-elektron bermuatan negatif yang beredar mengelilingi inti.
- Inti atom bermuatan positif karena mengandung proton. Atom bersifat netral karena jumlah proton dalam inti sama dengan jumlah elektron yang mengelilingi inti.
- Sebagian besar volume atom merupakan ruang kosong. Hampir semua massa atom positif berpusat pada inti atom yang sangat kecil. Jari-jari atom sekitar 10⁻⁹ m sedangkan jari-jari inti atom sekitar 10⁻¹⁵ m.
4. Teori atom Niels Bohr (1913)
- Memperbaiki kelemahan Rutherford dengan mendasarkan pada teori atom Rutherford dan teori kuantum.
- Dalam teorinya Niels Bohr menyatakan bahwa:
- Elektron beredar mengelilingi inti pada lintasan stasioner dengan tingkat energi tertentu tanpa disertai pemancaran atau penyerapan energi. Lintasan ini disebut kulit atom, yaitu orbit berbentuk lingkaran dengan jari-jari tertentu. Tiap lintasan ditandai dengan satu bilangan bulat yang disebut bilangan kuantum utama (n) mulai dari 1, 2, 3 dan seterusnya dan diberi lambang K, L, M, dan seterusnya.
- Elektron dapat berpindah dari lintasan berenergi rendah (lintasan lebih dalam) ke lintasan berenergi lebih tinggi (lintasan lebih luas) dengan menyerap energi dari lingkungannya. Sebaliknya, elektron-elektron berpindah dari lintasan lebih luar ke lintasan lebih dalam, maka akan melepaskan energi.
Dalam model atom Bohr dikenal istilah-istilah:
- Konfigurasi elektron Yaitu susunan elektron pada masing-masing kulit. Konfigurasi elektron dinyatakan dengan nomor atom unsur atau jumlah elektron dalam atom unsur tersebut.
- Elektron valensi Yaitu elektron pada kulit terluar. Susunan elektron valensi sangat menentukan sifat-sifat kimia suatu atom dan berperan penting dalam membentuk ikatan dengan atom lain.
5. Model atom mekanika gelombang -Teori atom Modern (1926)
- Berdasarkan hipotesis Louis de Broglie (prinsip dualisme gelombang), Heisenberg mengemukakan prinsip ketidakpastiannya bahwa kedudukan elektron di sekeliling inti adalah kebolehjadian untuk mendapatkan elektron disebut orbital.
- Bentuk dan tingkat energi orbital dirumuskan oleh Erwin Schrodinger.
SOAL JAWAB SOAL TEORI ATOM
1. UN 2013 - Kelemahan teori atom Dalton adalah tidak menjelaskan...- Atom memiliki inti dan elektron
- Atorm dari unsur sejenis memiliki sifat yang berbeda
- Atom-atom gas tidak dapat bergabung
- Atom tidak bisa dibagi-bagi
- Atom dapat bergabung membentuk molekul
2. UN 2013 - Kelemahan teori atom Rutherford adalah...
- Elektron yang mengelilingi inti akan menyerap energi.
- Elektron menyebar merata dipermukaan bola atom.
- Elektron berputar mengelilingi inti seperti tata surya.
- Elektron mengelilingi inti memancarkan gelombang elektromagnetik.
- Atom terdiri dari muatan positif dan muatan negatif.
3. UN 2013 - Manakah pernyataan berikut ini yang merupakan kelemahan teori atom Bohr?
- Tidak dapat menjelaskan efek Zeeman.
- Tidak dapat menjelaskan gaya sentripetal elektron.
- Bertentangan dengan fisika klasik.
- Bertentangan dengan teori Dalton.
- Tidak dapat menentukan energi transisi.
4. UN 2009 - Perbedaan utama antara model atom Rutherford dan model atom Bohr adalah....
- Elektron berputar mengelilingi inti dengan membebaskan sejumlah energi.
- Elektron merupakan bagian atom yang bermuatan negatif.
- Atom berbentuk bola kosong dengan inti berada di tengah.
- Secara keseluruhan atom bersifat netral.
- Massa atom terpusat pada inti atom.
5. UN 2010 - Perhatikan pernyataan-pernyataan berikut: Atom terdiri dari elektron yang bermuatan negatif dan inti atom yang bermuatan positif. Elektron mengorbit inti atom seperti planet mengorbit matahari. Elektron mengorbit inti atom pada orbit yang stasioner tanpa memancarkan energi. Yang membedakan model atom Rutherford dan model atom Thomson adalah pernyataan....
- (1), (2), dan (3)
- (1) saja
- (2) saja
- (3) saja
- (1) dan (3) saja
6. UN 2013 - Pernyataan atau data hasil pengamatan yang menjadikan kelemahan model atom Thompson adalah...
- Sebagian partikel alfa melewati lempeng emas tanpa mengalami pembelokan
- Hamburan sinar alfa oleh elektron yang dihamburkan menjadi lebih besar
- Muatan positif pada bola atom dinetralkan oleh elektron yang bermuatan negatif
- Atom bersifat netral dengan elektron tersebar merata pada permukaan bola atom
- Massa atom tersebar merata pada bola atom
7. UN 2009 - Energi elektron pada keadaan dasar di dalam atom hidrogen adalah −13,6 eV. Energi elektron pada orbit dengan bilangan kuantum n = 4 adalah....
- -1,36 eV
- -1,24 eV
- -0,96 eV
- -0,85 eV
- -0,76 eV
8. UN 2010 - Jika persamaan energi lintasan elektron tunggal dari sebuah atom hidrogen adalah $ En =-\frac{13,6}{n^{2}}eV$ maka, sebuah elektron yang tereksitasi dari lintasan n = 1 ke n = 4 mengalami perubahan energi elektron sebesar....
- 12,75 eV
- 10,20 eV
- 7,20 eV
- 6,85 eV
- 3,40 eV
9. UN 2010 - Dalam model atom Bohr, ketika elektron atom hidrogen berpindah dari orbit dengan bilangan kuantum n = 1, ke n = 3, maka elektron tersebut akan....($ En =-\frac{13,6}{n^{2}}eV$ ).
- menyerap energi sebesar 1,50 eV
- memancarkan energi sebesar 1,50 eV
- menyerap energi sebesar 2,35 eV
- memancarkan energi sebesar 12,09 eV
- menyerap energi sebesar 12,09 eV