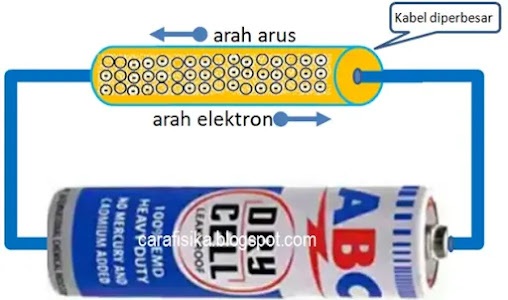
Arah aliran arus listrik terbagi menjadi dua jenis, yaitu arus searah dan arus bolak-balik. Arus searah atau yang dikenal juga direct current (DC) yang mengalir dari titik berpotensial tinggi menuju titik berpotensial rendah.
SUMBER ARUS LISTRIK
Sumber arus listrik dibedakan menjadi dua, yaitu sumber arus listrik bolak-balik (AC) dan sumber arus listrik searah (DC). Sumber arus listrik AC dihasilkan oleh dinamo arus AC dan generator.
Sumber arus searah, misalnya sel volta, elemen kering (baterai), akumulator. Elemen ini merupakan sumber arus searah yang dihasilkan oleh reaksi kimia, sehingga sering disebut elektrokimia, karena mengubah energi kimia menjadi energi listrik.
Elemen dibedakan menjadi dua, yaitu elemen primer dan elemen sekunder.
- Elemen primer adalah sumber arus listrik yang bersifat sekali pakai, artinya tidak bisa diisi ulang. Contoh: elemen volta dan batu baterai.
- Elemen sekunder adalah elemen yang setelah habis muatannya dapat diisi kembali. Contoh: Baterai isi ulang (misalnya baterai HP), baterai penyimpanan (power bank), aki atau akumulator (baterai basah).
1. Elemen Volta
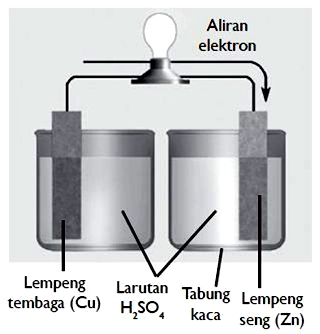
Elemen Volta adalah sumber arus listrik yang paling sederhana yang terbuat dari lempeng seng (Zn) dan sebuah lempeng tembaga (Cu) yang dicelupkan ke dalam larutan asam sulfat ($H_2SO_4$).
Elemen Volta adalah sumber arus listrik yang paling sederhana yang terbuat dari lempeng seng (Zn) dan sebuah lempeng tembaga (Cu) yang dicelupkan ke dalam larutan asam sulfat ($H_2SO_4$).
Bagian utama elemen Volta, yaitu:
- kutub positif (anode) dari tembaga (Cu),
- kutub negatif (katode) dari seng (Zn),
- larutan elektrolit dari asam sulfat ($H_2SO_4$).
Jika kedua lempeng logam itu dihubungkan melalui lampu, lampu akan menyala. Hal ini membuktikan adanya arus listrik yang mengalir pada lampu.
Ketika lampu menyala, larutan elektrolit akan bereaksi dengan logam tembaga maupun seng sehingga menghasilkan sejumlah elektron yang mengalir dari seng menuju tembaga.
Reaksi kimia pada elemen Volta adalah sebagai berikut.
- Pada larutan elektrolit: $\small H_2SO_4 \rightarrow 2H^+ + SO_2^{-4}$
- Pada kutub positif : $\small Cu + 2H^+ \rightarrow \textrm{polarisasi } H_2$
- Pada kutub negatif : $\small Zn + SO_4 \rightarrow ZnSO_4+2e$
Peristiwa tertutupnya lempeng tembaga oleh gelembung-gelembung gas hidrogen disebut polarisasi.
Adanya polarisasi gas hidrogen pada lempeng tembaga menyebabkan elemen Volta mampu mengalirkan arus listrik hanya sebentar. Tegangan tiap elemen Volta sekitar 1,1 volt.
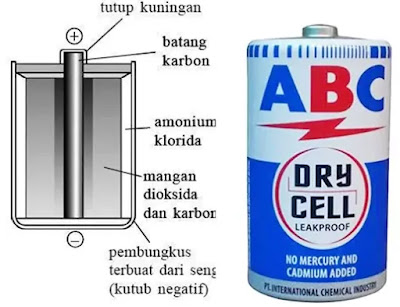
2. Elemen Kering
Elemen kering disebut juga baterai atau baterai kering. Elemen kering pertama kali dibuat oleh Leclance.Bagian utama elemen kering adalah
- kutub positif (anode) dari batang karbon (C)
- kutub negatif (katode) dari seng (Zn)
- larutan elektrolit dari amonium klorida ($NH_4Cl$)
- dispolarisator dari mangan dioksida ($MnO_2$).
Batang karbon (batang arang) memiliki potensial tinggi, sedangkan lempeng seng memiliki potensial rendah. Jika kedua elektrode itu dihubungkan dengan lampu maka arus listrik akan mengalir.
Reaksi kimia pada batu baterai adalah sebagai berikut.
- Pada larutan elektrolit : $\small Zn + 2NH_4Cl \rightarrow Zn^{2+} + 2Cl + 2NH_3 + H_2$
- Pada dispolarisator: $\small H_2 + 2MnO_2\rightarrow Mn_2O_3 + H_2O$
Elemen Sekunder
Akumulator atau Aki
Akumulator sering disebut aki. Elektrode akumulator baik anode dan katode terbuat dari timbal (Cu) berpori. 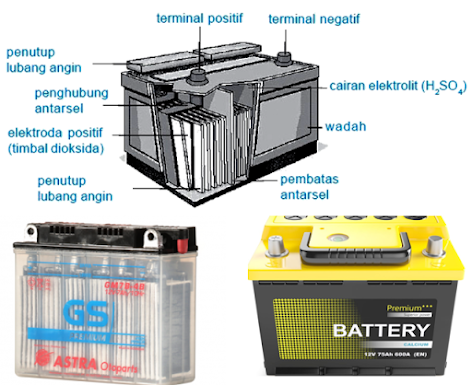
Bagian utama akumulator, yaitu

- kutup positif (anode) dari timbal dioksida ($PbO_2$),
- kutub negatif (katode) dari timbal murni ($Pb$),
- larutan elektrolit dari asam sulfat ($H_2SO_4$ ) kepekatan 30%.
Kemampuan akumulator dalam mengalirkan arus listrik disebut kapasitas akumulator yang dinyatakan dengan satuan Ampere Hour (AH).
Kapasitas akumulator 50 AH artinya akumulator mampu mengalirkan arus listrik 1 ampere yang dapat bertahan selama 50 jam tanpa pengisian kembali.
a. Proses Pengosongan Akumulator
Pada saat digunakan, terjadi reaksi antara larutan elektrolit dengan timbal dioksida dan timbal murni menjadi timbal sulfat ($PbSO_4$)sekaligus menghasilkan elektron dan air.
Reaksi kimia pada akumulator yang dikosongkan adalah sebagai berikut.
- Pada elektrolit : $\small H_2SO_4\rightarrow 2H^+ + SO_4^{2-}$
- Pada anode: $\small PbO_2 + 2H^+ + 2e + H_2SO_4 \rightarrow PbSO_4+2H_2O$
- Pada katode : $\small Pb + SO_4^{2-}\rightarrow PbSO_4+2e$
b. Proses Pengisian Akumulator
Pada saat pengisian terjadi penguapan asam sulfat, sehingga menambah kepekatan asam sulfat dan permukaan asam sulfat turun. Oleh sebab itu, perlu ditambah air akumulator kembali.
Reaksi kimia saat akumulator diisi, yaitu
- pada elektrolit : $\small H_2SO_4 \rightarrow 2H^+ + SO_4^{2-}$
- pada anode : $\small PbSO_4 + SO_4^{2-} + 2H2O\rightarrow PbO_2 + 2H_2SO_4$
- pada katode: $\small PbSO_4 + 2H^+ \rightarrow Pb + H_2SO_4$
Dinamo Arus Searah
Lain halnya dengan elemen di atas, dinamo arus searah berfungsi mengubah energi gerak menjadi energi listrik.
Dinamo Arus Searah atau terkenal dengan nama Dinamo sepeda intinya adalah sebuah magnet yang dapat berputar dan sebuah kumparan tetap.
Apabila roda sepeda diputar dan dinamo akan berputar sehingga roda akan memutar magnet, biasanya dinamo dapat menghasilkan tegangan 6 sampai 12 Volt dan menghasilkan arus sekitar 450 mA.
Panel surya (Solar Panel)
Panel surya adalah alat yang terdiri dari sel surya yang mengubah cahaya menjadi listrik. Mereka disebut surya atas Matahari atau "sol" karena Matahari merupakan sumber cahaya terkuat yang dapat dimanfaatkan.
Panel surya adalah alat yang terdiri dari sel surya yang mengubah cahaya menjadi listrik. Mereka disebut surya atas Matahari atau "sol" karena Matahari merupakan sumber cahaya terkuat yang dapat dimanfaatkan.

Panel surya sering kali disebut sel fotovoltaik, photovoltaic dapat diartikan sebagai "cahaya-listrik".